QUÍMICA ANALÍTICA II
O ácido iopanóico é muito utilizado como solução oral como contraste radiopaco. Uma amostra 190,32 mg de ácido iopanóico foi tratada com NaOH conforme apresentado na reação a seguir:
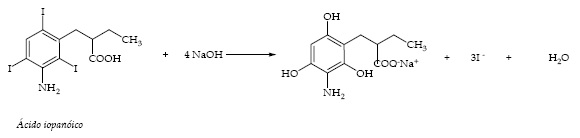
Como pode observar na reação acima o tratamento com NaOH libera 3 mols de iodeto (I-) para cada mol de ácido iopanóico. A seguir, utilizando-se um indicador adequado, procedeu-se a uma titulação do iodeto liberado com AgNO3 0,05 mol/L, gastando-se 20,00 mL para atingir o ponto final da titulação. A partir destas informações, determine o teor (%) de ácido iopanóico presente na amostra. Dado: Ácido Iopanóico: 570,93 g/mol
69,30 %
50,89 %
99,89 %
59,94 %
89,99 %
100 mL de uma solução aquosa de ácido clorídrico 1 mol/L foram misturados a 100 mL de uma solução aquosa de nitrato de prata 1 mol/L, formando um precipitado de cloreto de prata, de acordo com a equação:
HCl + AgNO3 → AgCl + HNO3
Em relação a esse processo, todas as afirmativas estão corretas, EXCETO:
O sistema final é constituído de duas fases.
A reação produz um mol de cloreto de prata.
O pH permanece inalterado durante a reação.
A concentração do íon nitrato na mistura é 0,5 mol/L.
O cloreto de prata é muito pouco solúvel em água.
50 mL de uma solução aquosa de NaOH foram titulados com 25,0 mL de solução 0,2 mol L-1 de HCl. Com base nessas informações, qual alternativa contém a correta concentração molar da solução de hidróxido ?
0,2 mol L-1
0,5 mol L-1
0,02 mol L-1
0,01 mol L-1
0,1 mol L-1
O gráfico abaixo demonstra a curva de pH, criada à partir de uma titulação de um ácido e uma base. Baseado nas características da curva, podemos afirmar que as substâncias envolvidas nessa titulação de neutralização são:
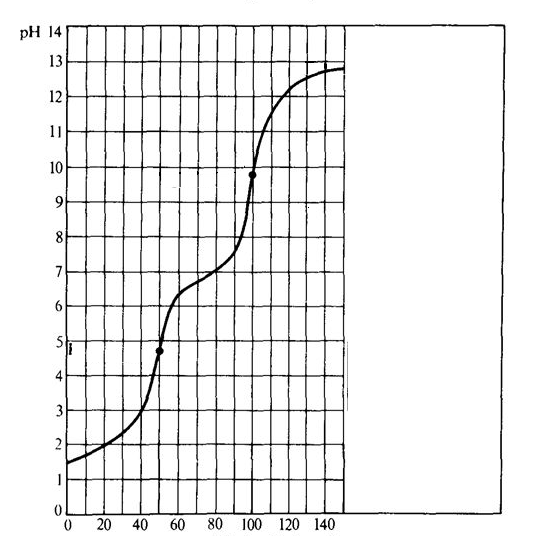
Titulante: H3PO4 ; Titulado: NaOH
Titulante: HCl ; Titulado: Mg(OH)2
Titulante: NaOH ; Titulado: HCl
Titulante: NaOH ; Titulado: H2SO4
Titulante: Ba(OH)2 ; Titulado: HCl
A aspirina (ácido acetilsalicílico, massa molar = 180,16 g/mol), pode ser determinada analiticamente em um laboratório, mediante sua hidrólise com uma quantidade conhecida de um excesso de uma base forte, tal como o NaOH, fervendo-se por 10 minutos e depois titule a base remanescente com um ácido padrão. (1 mol AAS – 2 mol NaOH)
Considerando que uma amostra de 0,2775 g foi originalmente pesada, e que 50,0 mL de uma solução aquosa de NaOH 0,100 mol/L foram usados no procedimento de hidrólise, e que 12,05 mL de uma solução de HCl 0,2000 mol/L foram necessários para titular o excesso de base, usando-se o vermelho de fenol como indicador, qual é a porcentagem aproximada de pureza da amostra?
50%
62%
84 %
75%
99%
Os conceitos de volumetria de precipitação e complexação podem ser úteis para determinar a quantidade de íons cálcio e magnésio em amostras biológicas. Para se determinar a massa (mg) de cálcio e magnésio em urina basta fazer uma titulação complexiométrica associada a precipitação do cálcio utilizando oxalato. Uma amostra de urina (100mL) depois de tratada para ajustar o pH para 10 é titulada com solução padrão de EDTA 0,001343 M, gastando um volume de 18,30 mL. Para precipitar todo o cálcio presente em outra amostra de 100 mL usou-se oxalato como agente precipitante. O precipitado foi filtrado e o sobrenadante foi titulado com a mesma solução de EDTA gastando 8,30 mL de solução padrão. Qual a quantidade de Ca2+ e Mg2+, em mg, na amostra de urina? Dados: Ca à 40 g/mol e Mg à 24,3 g/mol
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,464 mg
Massa Ca2+= 0,326 mg e Massa Mg2+ = 0,644 mg
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,446 mg
Massa Ca2+= 0,537 mg e Massa Mg2+ = 0,268 mg
Massa Ca2+= 0,446 mg e Massa Mg2+ = 0,326 mg
Uma amostra de 50 mL de água oxigenada foi titulada em meio sulfúrico com permanganato de potássio 0,1 M, gastando-se 22,3 mL da solução oxidante. A reação que ocorre é :
2 KmnO4 + 5 H2O2 + 3 H2SO4 à K2SO4 + 2 MnSO4 + 8 H2O + 5 O2 .
Assinale a alternativa que corresponde à concentração em mol/L da solução de água oxigenada.
0,1564 mol/L
0,1115 mol/L
0,5325 mol/L
0,3498 mol/L
0,5065 mol/L
188,1 mg de As2O3 (MM = 198 g/mol) foram convenientemente solubilizados e titulados por 37,6 mL solução de I2, em presença de NaHCO3. Calcule a concentração molar da solução de iodo (MM = 127 g/mol).
I2 + 2 e - <--> 2 I-
As2O3 + 6 NaOH <--> 2 Na3AsO3 + 3 H2O
I2 + H3AsO3 <--> 2 I- + H3AsO4 + 2 H+
2,7665 mol/L
0,0505 mol/L
0,9032 mol/L
0,1009 mol/L
3,0076 mol/L
Para determinar a curva de titulação de uma amostra contendo Fe2+ a 0,5 mol/L um químico titulou 50 mL da amostra com Ce4+ de concentração 0,5 mol/L. Calcule o valor de Esistema quando foram adicionados 10 mL de solução de Ce4+ no erlenmeyer e assinale a alternativa correta.
E° Fe3+/Fe2+ = +0,77 V
E° Ce4+/Ce3+ = +1,44 V

69,30 %
50,89 %
99,89 %
59,94 %
89,99 %
100 mL de uma solução aquosa de ácido clorídrico 1 mol/L foram misturados a 100 mL de uma solução aquosa de nitrato de prata 1 mol/L, formando um precipitado de cloreto de prata, de acordo com a equação:
HCl + AgNO3 → AgCl + HNO3
Em relação a esse processo, todas as afirmativas estão corretas, EXCETO:
O sistema final é constituído de duas fases.
A reação produz um mol de cloreto de prata.
O pH permanece inalterado durante a reação.
A concentração do íon nitrato na mistura é 0,5 mol/L.
O cloreto de prata é muito pouco solúvel em água.
50 mL de uma solução aquosa de NaOH foram titulados com 25,0 mL de solução 0,2 mol L-1 de HCl. Com base nessas informações, qual alternativa contém a correta concentração molar da solução de hidróxido ?
0,2 mol L-1
0,5 mol L-1
0,02 mol L-1
0,01 mol L-1
0,1 mol L-1
O gráfico abaixo demonstra a curva de pH, criada à partir de uma titulação de um ácido e uma base. Baseado nas características da curva, podemos afirmar que as substâncias envolvidas nessa titulação de neutralização são:

Titulante: H3PO4 ; Titulado: NaOH
Titulante: HCl ; Titulado: Mg(OH)2
Titulante: NaOH ; Titulado: HCl
Titulante: NaOH ; Titulado: H2SO4
Titulante: Ba(OH)2 ; Titulado: HCl
A aspirina (ácido acetilsalicílico, massa molar = 180,16 g/mol), pode ser determinada analiticamente em um laboratório, mediante sua hidrólise com uma quantidade conhecida de um excesso de uma base forte, tal como o NaOH, fervendo-se por 10 minutos e depois titule a base remanescente com um ácido padrão. (1 mol AAS – 2 mol NaOH)
Considerando que uma amostra de 0,2775 g foi originalmente pesada, e que 50,0 mL de uma solução aquosa de NaOH 0,100 mol/L foram usados no procedimento de hidrólise, e que 12,05 mL de uma solução de HCl 0,2000 mol/L foram necessários para titular o excesso de base, usando-se o vermelho de fenol como indicador, qual é a porcentagem aproximada de pureza da amostra?
50%
62%
84 %
75%
99%
Os conceitos de volumetria de precipitação e complexação podem ser úteis para determinar a quantidade de íons cálcio e magnésio em amostras biológicas. Para se determinar a massa (mg) de cálcio e magnésio em urina basta fazer uma titulação complexiométrica associada a precipitação do cálcio utilizando oxalato. Uma amostra de urina (100mL) depois de tratada para ajustar o pH para 10 é titulada com solução padrão de EDTA 0,001343 M, gastando um volume de 18,30 mL. Para precipitar todo o cálcio presente em outra amostra de 100 mL usou-se oxalato como agente precipitante. O precipitado foi filtrado e o sobrenadante foi titulado com a mesma solução de EDTA gastando 8,30 mL de solução padrão. Qual a quantidade de Ca2+ e Mg2+, em mg, na amostra de urina? Dados: Ca à 40 g/mol e Mg à 24,3 g/mol
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,464 mg
Massa Ca2+= 0,326 mg e Massa Mg2+ = 0,644 mg
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,446 mg
Massa Ca2+= 0,537 mg e Massa Mg2+ = 0,268 mg
Massa Ca2+= 0,446 mg e Massa Mg2+ = 0,326 mg
Uma amostra de 50 mL de água oxigenada foi titulada em meio sulfúrico com permanganato de potássio 0,1 M, gastando-se 22,3 mL da solução oxidante. A reação que ocorre é :
2 KmnO4 + 5 H2O2 + 3 H2SO4 à K2SO4 + 2 MnSO4 + 8 H2O + 5 O2 .
Assinale a alternativa que corresponde à concentração em mol/L da solução de água oxigenada.
0,1564 mol/L
0,1115 mol/L
0,5325 mol/L
0,3498 mol/L
0,5065 mol/L
188,1 mg de As2O3 (MM = 198 g/mol) foram convenientemente solubilizados e titulados por 37,6 mL solução de I2, em presença de NaHCO3. Calcule a concentração molar da solução de iodo (MM = 127 g/mol).
I2 + 2 e - <--> 2 I-
As2O3 + 6 NaOH <--> 2 Na3AsO3 + 3 H2O
I2 + H3AsO3 <--> 2 I- + H3AsO4 + 2 H+
2,7665 mol/L
0,0505 mol/L
0,9032 mol/L
0,1009 mol/L
3,0076 mol/L
Para determinar a curva de titulação de uma amostra contendo Fe2+ a 0,5 mol/L um químico titulou 50 mL da amostra com Ce4+ de concentração 0,5 mol/L. Calcule o valor de Esistema quando foram adicionados 10 mL de solução de Ce4+ no erlenmeyer e assinale a alternativa correta.
E° Fe3+/Fe2+ = +0,77 V
E° Ce4+/Ce3+ = +1,44 V
O sistema final é constituído de duas fases.
A reação produz um mol de cloreto de prata.
O pH permanece inalterado durante a reação.
A concentração do íon nitrato na mistura é 0,5 mol/L.
O cloreto de prata é muito pouco solúvel em água.
50 mL de uma solução aquosa de NaOH foram titulados com 25,0 mL de solução 0,2 mol L-1 de HCl. Com base nessas informações, qual alternativa contém a correta concentração molar da solução de hidróxido ?
0,2 mol L-1
0,5 mol L-1
0,02 mol L-1
0,01 mol L-1
0,1 mol L-1
O gráfico abaixo demonstra a curva de pH, criada à partir de uma titulação de um ácido e uma base. Baseado nas características da curva, podemos afirmar que as substâncias envolvidas nessa titulação de neutralização são:

Titulante: H3PO4 ; Titulado: NaOH
Titulante: HCl ; Titulado: Mg(OH)2
Titulante: NaOH ; Titulado: HCl
Titulante: NaOH ; Titulado: H2SO4
Titulante: Ba(OH)2 ; Titulado: HCl
A aspirina (ácido acetilsalicílico, massa molar = 180,16 g/mol), pode ser determinada analiticamente em um laboratório, mediante sua hidrólise com uma quantidade conhecida de um excesso de uma base forte, tal como o NaOH, fervendo-se por 10 minutos e depois titule a base remanescente com um ácido padrão. (1 mol AAS – 2 mol NaOH)
Considerando que uma amostra de 0,2775 g foi originalmente pesada, e que 50,0 mL de uma solução aquosa de NaOH 0,100 mol/L foram usados no procedimento de hidrólise, e que 12,05 mL de uma solução de HCl 0,2000 mol/L foram necessários para titular o excesso de base, usando-se o vermelho de fenol como indicador, qual é a porcentagem aproximada de pureza da amostra?
50%
62%
84 %
75%
99%
Os conceitos de volumetria de precipitação e complexação podem ser úteis para determinar a quantidade de íons cálcio e magnésio em amostras biológicas. Para se determinar a massa (mg) de cálcio e magnésio em urina basta fazer uma titulação complexiométrica associada a precipitação do cálcio utilizando oxalato. Uma amostra de urina (100mL) depois de tratada para ajustar o pH para 10 é titulada com solução padrão de EDTA 0,001343 M, gastando um volume de 18,30 mL. Para precipitar todo o cálcio presente em outra amostra de 100 mL usou-se oxalato como agente precipitante. O precipitado foi filtrado e o sobrenadante foi titulado com a mesma solução de EDTA gastando 8,30 mL de solução padrão. Qual a quantidade de Ca2+ e Mg2+, em mg, na amostra de urina? Dados: Ca à 40 g/mol e Mg à 24,3 g/mol
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,464 mg
Massa Ca2+= 0,326 mg e Massa Mg2+ = 0,644 mg
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,446 mg
Massa Ca2+= 0,537 mg e Massa Mg2+ = 0,268 mg
Massa Ca2+= 0,446 mg e Massa Mg2+ = 0,326 mg
Uma amostra de 50 mL de água oxigenada foi titulada em meio sulfúrico com permanganato de potássio 0,1 M, gastando-se 22,3 mL da solução oxidante. A reação que ocorre é :
2 KmnO4 + 5 H2O2 + 3 H2SO4 à K2SO4 + 2 MnSO4 + 8 H2O + 5 O2 .
Assinale a alternativa que corresponde à concentração em mol/L da solução de água oxigenada.
0,1564 mol/L
0,1115 mol/L
0,5325 mol/L
0,3498 mol/L
0,5065 mol/L
188,1 mg de As2O3 (MM = 198 g/mol) foram convenientemente solubilizados e titulados por 37,6 mL solução de I2, em presença de NaHCO3. Calcule a concentração molar da solução de iodo (MM = 127 g/mol).
I2 + 2 e - <--> 2 I-
As2O3 + 6 NaOH <--> 2 Na3AsO3 + 3 H2O
I2 + H3AsO3 <--> 2 I- + H3AsO4 + 2 H+
2,7665 mol/L
0,0505 mol/L
0,9032 mol/L
0,1009 mol/L
3,0076 mol/L
Para determinar a curva de titulação de uma amostra contendo Fe2+ a 0,5 mol/L um químico titulou 50 mL da amostra com Ce4+ de concentração 0,5 mol/L. Calcule o valor de Esistema quando foram adicionados 10 mL de solução de Ce4+ no erlenmeyer e assinale a alternativa correta.
E° Fe3+/Fe2+ = +0,77 V
E° Ce4+/Ce3+ = +1,44 V
0,2 mol L-1
0,5 mol L-1
0,02 mol L-1
0,01 mol L-1
0,1 mol L-1
O gráfico abaixo demonstra a curva de pH, criada à partir de uma titulação de um ácido e uma base. Baseado nas características da curva, podemos afirmar que as substâncias envolvidas nessa titulação de neutralização são:

Titulante: H3PO4 ; Titulado: NaOH
Titulante: HCl ; Titulado: Mg(OH)2
Titulante: NaOH ; Titulado: HCl
Titulante: NaOH ; Titulado: H2SO4
Titulante: Ba(OH)2 ; Titulado: HCl
A aspirina (ácido acetilsalicílico, massa molar = 180,16 g/mol), pode ser determinada analiticamente em um laboratório, mediante sua hidrólise com uma quantidade conhecida de um excesso de uma base forte, tal como o NaOH, fervendo-se por 10 minutos e depois titule a base remanescente com um ácido padrão. (1 mol AAS – 2 mol NaOH)
Considerando que uma amostra de 0,2775 g foi originalmente pesada, e que 50,0 mL de uma solução aquosa de NaOH 0,100 mol/L foram usados no procedimento de hidrólise, e que 12,05 mL de uma solução de HCl 0,2000 mol/L foram necessários para titular o excesso de base, usando-se o vermelho de fenol como indicador, qual é a porcentagem aproximada de pureza da amostra?
50%
62%
84 %
75%
99%
Os conceitos de volumetria de precipitação e complexação podem ser úteis para determinar a quantidade de íons cálcio e magnésio em amostras biológicas. Para se determinar a massa (mg) de cálcio e magnésio em urina basta fazer uma titulação complexiométrica associada a precipitação do cálcio utilizando oxalato. Uma amostra de urina (100mL) depois de tratada para ajustar o pH para 10 é titulada com solução padrão de EDTA 0,001343 M, gastando um volume de 18,30 mL. Para precipitar todo o cálcio presente em outra amostra de 100 mL usou-se oxalato como agente precipitante. O precipitado foi filtrado e o sobrenadante foi titulado com a mesma solução de EDTA gastando 8,30 mL de solução padrão. Qual a quantidade de Ca2+ e Mg2+, em mg, na amostra de urina? Dados: Ca à 40 g/mol e Mg à 24,3 g/mol
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,464 mg
Massa Ca2+= 0,326 mg e Massa Mg2+ = 0,644 mg
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,446 mg
Massa Ca2+= 0,537 mg e Massa Mg2+ = 0,268 mg
Massa Ca2+= 0,446 mg e Massa Mg2+ = 0,326 mg
Uma amostra de 50 mL de água oxigenada foi titulada em meio sulfúrico com permanganato de potássio 0,1 M, gastando-se 22,3 mL da solução oxidante. A reação que ocorre é :
2 KmnO4 + 5 H2O2 + 3 H2SO4 à K2SO4 + 2 MnSO4 + 8 H2O + 5 O2 .
Assinale a alternativa que corresponde à concentração em mol/L da solução de água oxigenada.
0,1564 mol/L
0,1115 mol/L
0,5325 mol/L
0,3498 mol/L
0,5065 mol/L
188,1 mg de As2O3 (MM = 198 g/mol) foram convenientemente solubilizados e titulados por 37,6 mL solução de I2, em presença de NaHCO3. Calcule a concentração molar da solução de iodo (MM = 127 g/mol).
I2 + 2 e - <--> 2 I-
As2O3 + 6 NaOH <--> 2 Na3AsO3 + 3 H2O
I2 + H3AsO3 <--> 2 I- + H3AsO4 + 2 H+
2,7665 mol/L
0,0505 mol/L
0,9032 mol/L
0,1009 mol/L
3,0076 mol/L
Para determinar a curva de titulação de uma amostra contendo Fe2+ a 0,5 mol/L um químico titulou 50 mL da amostra com Ce4+ de concentração 0,5 mol/L. Calcule o valor de Esistema quando foram adicionados 10 mL de solução de Ce4+ no erlenmeyer e assinale a alternativa correta.
E° Fe3+/Fe2+ = +0,77 V
E° Ce4+/Ce3+ = +1,44 V

Titulante: H3PO4 ; Titulado: NaOH
Titulante: HCl ; Titulado: Mg(OH)2
Titulante: NaOH ; Titulado: HCl
Titulante: NaOH ; Titulado: H2SO4
Titulante: Ba(OH)2 ; Titulado: HCl
A aspirina (ácido acetilsalicílico, massa molar = 180,16 g/mol), pode ser determinada analiticamente em um laboratório, mediante sua hidrólise com uma quantidade conhecida de um excesso de uma base forte, tal como o NaOH, fervendo-se por 10 minutos e depois titule a base remanescente com um ácido padrão. (1 mol AAS – 2 mol NaOH)
Considerando que uma amostra de 0,2775 g foi originalmente pesada, e que 50,0 mL de uma solução aquosa de NaOH 0,100 mol/L foram usados no procedimento de hidrólise, e que 12,05 mL de uma solução de HCl 0,2000 mol/L foram necessários para titular o excesso de base, usando-se o vermelho de fenol como indicador, qual é a porcentagem aproximada de pureza da amostra?
50%
62%
84 %
75%
99%
Os conceitos de volumetria de precipitação e complexação podem ser úteis para determinar a quantidade de íons cálcio e magnésio em amostras biológicas. Para se determinar a massa (mg) de cálcio e magnésio em urina basta fazer uma titulação complexiométrica associada a precipitação do cálcio utilizando oxalato. Uma amostra de urina (100mL) depois de tratada para ajustar o pH para 10 é titulada com solução padrão de EDTA 0,001343 M, gastando um volume de 18,30 mL. Para precipitar todo o cálcio presente em outra amostra de 100 mL usou-se oxalato como agente precipitante. O precipitado foi filtrado e o sobrenadante foi titulado com a mesma solução de EDTA gastando 8,30 mL de solução padrão. Qual a quantidade de Ca2+ e Mg2+, em mg, na amostra de urina? Dados: Ca à 40 g/mol e Mg à 24,3 g/mol
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,464 mg
Massa Ca2+= 0,326 mg e Massa Mg2+ = 0,644 mg
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,446 mg
Massa Ca2+= 0,537 mg e Massa Mg2+ = 0,268 mg
Massa Ca2+= 0,446 mg e Massa Mg2+ = 0,326 mg
Uma amostra de 50 mL de água oxigenada foi titulada em meio sulfúrico com permanganato de potássio 0,1 M, gastando-se 22,3 mL da solução oxidante. A reação que ocorre é :
2 KmnO4 + 5 H2O2 + 3 H2SO4 à K2SO4 + 2 MnSO4 + 8 H2O + 5 O2 .
Assinale a alternativa que corresponde à concentração em mol/L da solução de água oxigenada.
0,1564 mol/L
0,1115 mol/L
0,5325 mol/L
0,3498 mol/L
0,5065 mol/L
188,1 mg de As2O3 (MM = 198 g/mol) foram convenientemente solubilizados e titulados por 37,6 mL solução de I2, em presença de NaHCO3. Calcule a concentração molar da solução de iodo (MM = 127 g/mol).
I2 + 2 e - <--> 2 I-
As2O3 + 6 NaOH <--> 2 Na3AsO3 + 3 H2O
I2 + H3AsO3 <--> 2 I- + H3AsO4 + 2 H+
2,7665 mol/L
0,0505 mol/L
0,9032 mol/L
0,1009 mol/L
3,0076 mol/L
Para determinar a curva de titulação de uma amostra contendo Fe2+ a 0,5 mol/L um químico titulou 50 mL da amostra com Ce4+ de concentração 0,5 mol/L. Calcule o valor de Esistema quando foram adicionados 10 mL de solução de Ce4+ no erlenmeyer e assinale a alternativa correta.
E° Fe3+/Fe2+ = +0,77 V
E° Ce4+/Ce3+ = +1,44 V
50%
62%
84 %
75%
99%
Os conceitos de volumetria de precipitação e complexação podem ser úteis para determinar a quantidade de íons cálcio e magnésio em amostras biológicas. Para se determinar a massa (mg) de cálcio e magnésio em urina basta fazer uma titulação complexiométrica associada a precipitação do cálcio utilizando oxalato. Uma amostra de urina (100mL) depois de tratada para ajustar o pH para 10 é titulada com solução padrão de EDTA 0,001343 M, gastando um volume de 18,30 mL. Para precipitar todo o cálcio presente em outra amostra de 100 mL usou-se oxalato como agente precipitante. O precipitado foi filtrado e o sobrenadante foi titulado com a mesma solução de EDTA gastando 8,30 mL de solução padrão. Qual a quantidade de Ca2+ e Mg2+, em mg, na amostra de urina? Dados: Ca à 40 g/mol e Mg à 24,3 g/mol
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,464 mg
Massa Ca2+= 0,326 mg e Massa Mg2+ = 0,644 mg
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,446 mg
Massa Ca2+= 0,537 mg e Massa Mg2+ = 0,268 mg
Massa Ca2+= 0,446 mg e Massa Mg2+ = 0,326 mg
Uma amostra de 50 mL de água oxigenada foi titulada em meio sulfúrico com permanganato de potássio 0,1 M, gastando-se 22,3 mL da solução oxidante. A reação que ocorre é :
2 KmnO4 + 5 H2O2 + 3 H2SO4 à K2SO4 + 2 MnSO4 + 8 H2O + 5 O2 .
Assinale a alternativa que corresponde à concentração em mol/L da solução de água oxigenada.
0,1564 mol/L
0,1115 mol/L
0,5325 mol/L
0,3498 mol/L
0,5065 mol/L
188,1 mg de As2O3 (MM = 198 g/mol) foram convenientemente solubilizados e titulados por 37,6 mL solução de I2, em presença de NaHCO3. Calcule a concentração molar da solução de iodo (MM = 127 g/mol).
I2 + 2 e - <--> 2 I-
As2O3 + 6 NaOH <--> 2 Na3AsO3 + 3 H2O
I2 + H3AsO3 <--> 2 I- + H3AsO4 + 2 H+
2,7665 mol/L
0,0505 mol/L
0,9032 mol/L
0,1009 mol/L
3,0076 mol/L
Para determinar a curva de titulação de uma amostra contendo Fe2+ a 0,5 mol/L um químico titulou 50 mL da amostra com Ce4+ de concentração 0,5 mol/L. Calcule o valor de Esistema quando foram adicionados 10 mL de solução de Ce4+ no erlenmeyer e assinale a alternativa correta.
E° Fe3+/Fe2+ = +0,77 V
E° Ce4+/Ce3+ = +1,44 V
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,464 mg
Massa Ca2+= 0,326 mg e Massa Mg2+ = 0,644 mg
Massa Ca2+= 0,236 mg e Massa Mg2+ = 0,446 mg
Massa Ca2+= 0,537 mg e Massa Mg2+ = 0,268 mg
Massa Ca2+= 0,446 mg e Massa Mg2+ = 0,326 mg
Uma amostra de 50 mL de água oxigenada foi titulada em meio sulfúrico com permanganato de potássio 0,1 M, gastando-se 22,3 mL da solução oxidante. A reação que ocorre é :
2 KmnO4 + 5 H2O2 + 3 H2SO4 à K2SO4 + 2 MnSO4 + 8 H2O + 5 O2 .
Assinale a alternativa que corresponde à concentração em mol/L da solução de água oxigenada.
0,1564 mol/L
0,1115 mol/L
0,5325 mol/L
0,3498 mol/L
0,5065 mol/L
188,1 mg de As2O3 (MM = 198 g/mol) foram convenientemente solubilizados e titulados por 37,6 mL solução de I2, em presença de NaHCO3. Calcule a concentração molar da solução de iodo (MM = 127 g/mol).
I2 + 2 e - <--> 2 I-
As2O3 + 6 NaOH <--> 2 Na3AsO3 + 3 H2O
I2 + H3AsO3 <--> 2 I- + H3AsO4 + 2 H+
2,7665 mol/L
0,0505 mol/L
0,9032 mol/L
0,1009 mol/L
3,0076 mol/L
Para determinar a curva de titulação de uma amostra contendo Fe2+ a 0,5 mol/L um químico titulou 50 mL da amostra com Ce4+ de concentração 0,5 mol/L. Calcule o valor de Esistema quando foram adicionados 10 mL de solução de Ce4+ no erlenmeyer e assinale a alternativa correta.
E° Fe3+/Fe2+ = +0,77 V
E° Ce4+/Ce3+ = +1,44 V
0,1564 mol/L
0,1115 mol/L
0,5325 mol/L
0,3498 mol/L
0,5065 mol/L
188,1 mg de As2O3 (MM = 198 g/mol) foram convenientemente solubilizados e titulados por 37,6 mL solução de I2, em presença de NaHCO3. Calcule a concentração molar da solução de iodo (MM = 127 g/mol).
I2 + 2 e - <--> 2 I-
As2O3 + 6 NaOH <--> 2 Na3AsO3 + 3 H2O
I2 + H3AsO3 <--> 2 I- + H3AsO4 + 2 H+
2,7665 mol/L
0,0505 mol/L
0,9032 mol/L
0,1009 mol/L
3,0076 mol/L
Para determinar a curva de titulação de uma amostra contendo Fe2+ a 0,5 mol/L um químico titulou 50 mL da amostra com Ce4+ de concentração 0,5 mol/L. Calcule o valor de Esistema quando foram adicionados 10 mL de solução de Ce4+ no erlenmeyer e assinale a alternativa correta.
E° Fe3+/Fe2+ = +0,77 V
E° Ce4+/Ce3+ = +1,44 V
2,7665 mol/L
0,0505 mol/L
0,9032 mol/L
0,1009 mol/L
3,0076 mol/L